КАРИОЛОГИЧЕСКИЙ АНАЛИЗ ГЕНОТИПОВ РАЗНОГО УРОВНЯ ПЛОИДНОСТИ НА ПРИМЕРЕ ФОРМ РОДА RIBES L. Дубровский М.Л.
:: Обсуждения, беседы, обмен опытом :: Обсуждение присланных на конференцию "Новые сорта садовых культур: их достоинства и экономическая эффективность возделывания" материалов
Страница 1 из 1
 КАРИОЛОГИЧЕСКИЙ АНАЛИЗ ГЕНОТИПОВ РАЗНОГО УРОВНЯ ПЛОИДНОСТИ НА ПРИМЕРЕ ФОРМ РОДА RIBES L. Дубровский М.Л.
КАРИОЛОГИЧЕСКИЙ АНАЛИЗ ГЕНОТИПОВ РАЗНОГО УРОВНЯ ПЛОИДНОСТИ НА ПРИМЕРЕ ФОРМ РОДА RIBES L. Дубровский М.Л.
УДК 58.086: 576.316: 634.72
КАРИОЛОГИЧЕСКИЙ АНАЛИЗ ГЕНОТИПОВ РАЗНОГО УРОВНЯ ПЛОИДНОСТИ НА ПРИМЕРЕ ФОРМ РОДА RIBES L.
Дубровский М.Л. – к. с.-х. н.
ГНУ ВНИИГиСПР им. И.В. Мичурина Россельхозакадемии,
г. Мичуринск, Россия
e-mail: element68@mail.ru
CARYOLOGICAL ANALYSIS OF GENOTYPES WITH DIFFERENT LEVEL OF PLOIDY ON AN EXAMPLE OF THE FORMS OF GENIUS RIBES L.
Dubrovsky M.L.
VNIIGISPR named after I.V. Michurin of RAAS, Michurinsk, Russia
e-mail: element68@mail.ru
Резюме
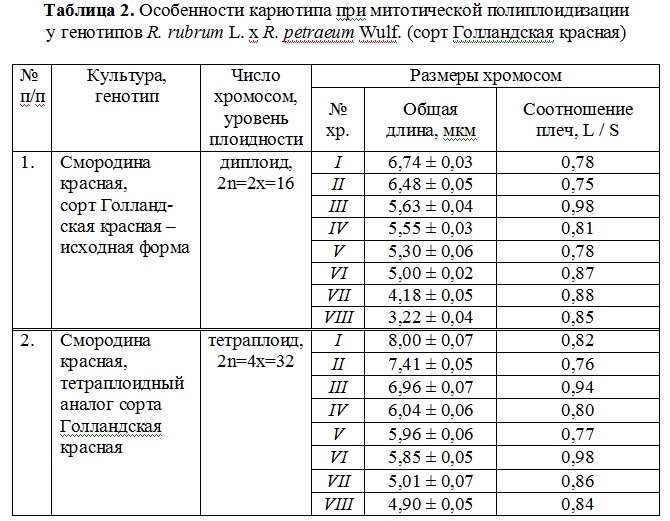
Наиболее точным методом определения уровня плоидности побега или всего растения является непосредственный подсчет соматического набора хромосом. У плодовых и ягодных культур лучшая контрастность хромосом отмечена на временных давленых ацетогематоксилиновых препаратах. По соотношению плеч хромосомы генотипов Ribes L. относятся к группе субметацентрических и метацентрических с индексом 0,62-0,98. Хромосомы тетраплоидов смородины в 1,1-1,5 раза длинее, чем у диплоидов.
Resume
The most precise method of determining the ploidy level of the shoot or the whole plant is the direct counting of somatic number of chromosomes. The highest contrast of chromosomes of fruit and berry crops was obtained at press temporary acetogematoxiline preparations. At the ratio of arms, chromosomes of the genotypes Ribes L. are submetacentric and metacentric with index 0,62-0,98. The chromosomes of tetraploids of currant longer in 1,1-1,5 times than diploids.
Непосредственный подсчет хромосом в клетках вегетативных тканей является наиболее точным способом определить уровень плоидности отдельного побега или всего растения. Поскольку данный процесс является трудоемким, требует определенных навыков и химических реактивов, то с целью экономии времени и снижения затрат его рекомендуется проводить после предварительного отбора по косвенным морфоцитологическим признакам измененных побегов, полученных после обработки амитотиками.
Существуют различные методические приемы и красители для приготовления цитологических микропрепаратов с целью подсчета числа хромосом и изучения метафазных пластинок у растений. Разработаны рекомендации по окрашиванию клеток ацетокармином, ацетоорсеином, ацетолакмоидом, реактивом Шиффа, красителем Гимза (Паушева, 1974; Пухальский и др., 2007). Для подсчета числа хромосом у плодовых и ягодных культур наилучшие результаты получены на временных давленых ацетогематоксилиновых препаратах по методике, разработанной в Центральной генетической лаборатории имени И.В. Мичурина Л.А. Топильской, С.В. Лучниковой, Н.П. Чувашиной (1975).
Для фиксации и окрашивания необходимы растительные ткани с активно делящимися вегетативными клетками – таким свойством обладают меристемы, расположенные в точках роста побегов или корней. Наиболее предпочтительны молодые корешки, образующиеся на срезанных побегах при их выдерживании во влажной среде (стакан с водой, увлажненные мох или вата). При этом наибольшее число митотических делений, как правило, отмечается в корешках длиной 3-5 мм, в более же длинных количество метафазных пластинок, пригодных для подсчета хромосом, несколько снижается. Количество делящихся клеток и синхронность стадий митотических делений можно повысить, помещая укореняемые черенки с водой на 1-2 суток в темноту или в холодильник либо сочетая оба фактора, а затем выставив их под электрическую лампу – через 2-3 часа в апексе корешков отмечается массовое деление клеток и в этот период их следует фиксировать.
У видов с трудноукореняемыми побегами можно фиксировать молодые листочки из распускающихся почек, однако из-за наличия фотосинтетических пигментов необходимым условием является их полное обесцвечивание перед началом приготовления цитологического препарата. Также можно фиксировать распускающиеся бутоны, особо учитывая, что в них для подсчета числа хромосом генотипа необходимо изучать только вегетативные клетки, образующие лепестки или чашелистики.
Фиксируемый биологический материал (корешки, молодые листочки, вегетативные ткани распускающихся бутонов) аккуратно срезают, помещают в пенициллиновые пузырьки или маленькие пробирки и заливают на 1-2 часа насыщенным раствором пара-дихлорбензола. Это стадия называется предобработкой и необходима для укорачивания и утолщения хромосом за счет конденсации ДНК-белкового комплекса, что в дальнейшем снижает вероятность их взаимного перекрывания в метафазной пластинке за счет меньшей длины, тем самым облегчая процесс их подсчета. Важно не передержать растительные ткани в пара-дихлорбензоле более 2 ч, иначе произойдет фрагментация хромосом и их корректный подсчет станет невозможен.
Затем биологический материал, не извлекая из пузырьков, тщательно промывают в 2-3 сменах дистиллированной воды и заливают фиксирующей жидкостью. В качестве фиксирующего раствора используют фиксатор Карнуа (6 частей по объему 96%-ного или абсолютного этанола, 3 части хлороформа и 1 часть ледяной уксусной кислоты) или уксуснокислый этанол (3 части 96%-ного или абсолютного этанола и 1 часть ледяной уксусной кислоты). Растительные ткани способны храниться в этих фиксаторах в холодильнике при +2...+4°С в течение нескольких месяцев, однако при продолжительном действии токсичных компонентов фиксирующей жидкости изменяется плотность, эластичность клеток и их способность к дальнейшей мацерации тканей и окрашиванию ядер клеток. Более мягкое действие оказывает фиксатор Навашина (непосредственно перед фиксацией смешиваются 10 частей 1%-ной хромовой кислоты, 4 части 16%-ного раствора формалина и 1 часть ледяной уксусной кислоты). Необходимо учитывать, что при комнатной температуре выдерживать растительный материал в фиксаторе не следует более 1-2 суток из-за ускоренного действия на клетки токсичных компонентов консервирующего раствора. Если микропрепарат планируется готовить сразу, то можно сразу приступать к процедурам мацерации и окрашивания растительных тканей без заливки консервирующей жидкостью.
При приготовлении временных микропрепаратов осуществляют последовательную проводку извлеченных из фиксатора объектов в маленьких стеклянных бюксах через кислоты – 15-20 минут в 20%-ной соляной кислоте для вымывания фиксирующей жидкости из растительных тканей, затем мацерация в однонормальном растворе соляной кислоты (30-60 мин. в зависимости от плотности растительных тканей), трехкратное промывание в дистиллированной воде для полного смыва соляной кислоты и заливка на 20-30 мин. уксусной кислотой для пропитывания тканей и удаления остатков соляной кислоты. Время обработки растительных тканей кислотами и красителем определяют экспериментально с учетом их плотности и времени хранения в фиксаторе. После этих операций зафиксированный биологический материал на сутки заливают ацетогематоксилином, после слива красителя бюкс наполняют дистиллированной водой. Затем препаровальной иглой отделяют от корешка апекс, помещают на стекло с лункой на 3-5 мин. в каплю дифференцирующего раствора – равной смеси по объему ледяной уксусной кислоты и насыщенного раствора хлоралгидрата. Затем апексы корешков помещают на предметное стекло по 3-6 штук, накрывают покровным стеклом и очень аккуратно нажимают, не смещая стекол друг относительно друга, чтобы не порвать клетки с расположенными в них хромосомами.
Готовый микропрепарат просматривают под микроскопом в проходящем свете сначала на малом увеличении (объективы 3,2х–10x) в поисках метафазных пластинок, а затем на большем увеличении (40х–60х) просматривают каждую из таких клеток, подсчитывая число хромосом и фотографируя. Для достоверного определения уровня плоидности изучаемого генотипа необходимо подсчитать хромосомы 10-15 метафазных пластинок. Для учета подходят метафазные пластинки с неперекрывающимися или незначительно перекрывающимися хромосомами, количество которых легко подсчитать. При наличии одинакового числа хромосом в просмотренных клетках исследуемая растительная ткань однородной по уровню плоидности. Если при подсчете обнаруживаются клетки с разным хромосомным набором, то изучаемый побег является химерным по уровню плоидности.
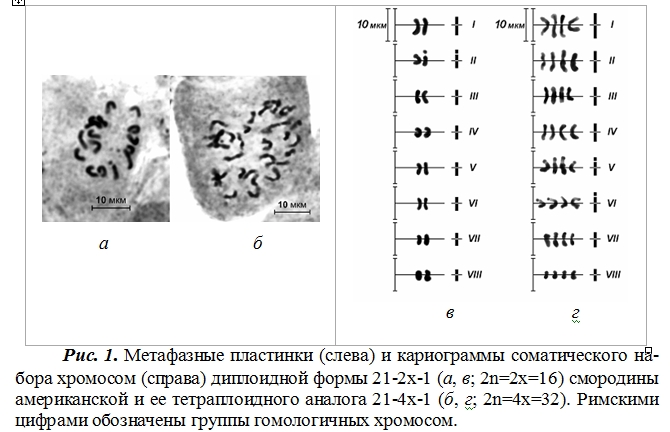
Целью данного исследования являлось изучение особенности морфологии хромосом диплоидных (2n=2x=16) и тетраплоидных (2n=4x=32) генотипов смородины американской (Ribes americanum Mill.) и красной сорта Голландская красная (R. rubrum L. x R. petraeum Wulf.). Среди плодовых и ягодных культур смородина является хорошим цитологическим объектом из-за небольшого диплоидного набора (2n=16), относительно крупных хромосом и возможности их сравнения и идентификации. Хромосомы семечковых и косточковых культур отличаются большим количеством в кариотипе и значительно меньшими размерами, что позволяет осуществить только подсчет их общего числа, без выявления детальных различий их морфологии.
У всех изучаемых авто- и аллотетраплоидов смородины в результате подсчета числа хромосом на временных цитологических микропрепаратах в клетках кончиков корешков установлено наличие 32 хромосом, т.е. 2n=4x.
Метафазные хромосомы тетраплоидов смородины американской имеют длину 3,8-8,2 мкм, диплоидов – 3,6-5,8 мкм (рис. 1, табл. 1), смородины красной – соответственно 3,2-6,7 мкм и 4,9-7,4 мкм (рис. 2; табл. 2). При сходных пропорциях большого (S) и малого плеч (L) хромосом, диплоиды отличаются большим их утолщением вследствие увеличенной конденсации ДНК-белкового комплекса. У всех генотипов смородины американской разного уровня плоидности отмечено наличие 1-2 спутничных хромосом в кариотипе, что является цитогенетической особенностью данного вида.
По соотношению плеч хромосомы генотипов смородины разного уровня плоидности относятся к группе субметацентрических и метацентрических с индексом 0,62-0,98; акроцентрические хромосомы отсутствуют. Общая длина хромосом у изучаемых тетраплоидов в 1,1-1,5 раза превышает соответствующие показатели диплоидов.
Таким образом, при селекции на полиплоидном уровне генотипов плодовых и ягодных культур кариологический анализ соматических клеток позволяет с наибольшей достоверностью установить уровень плоидности побегов или целых растений, а при наличии крупных хромосом провести детальный анализ их морфологии. Соотношения плеч и средняя длина каждой из хромосом является видовым цитологическим признаком.
1. Паушева, З.П. Практикум по цитологии растений / З.П. Паушева. – Изд. 2-е, перераб. и доп. – М.: Колос, 1974. – 288 с.
2. Пухальский, В.А. Практикум по цитологии и цитогенетики растений / В.А. Пухальский, А.А. Соловьев, Е.Д. Бадаева, В.Н. Юрцев. – М.: КолосС, 2007. – 198 с.
3. Топильская, Л.А. Изучение соматических и мейотических хромосом смородины на ацетогематоксилиновых давленых препаратах / Л.А. Топильская, С.В. Лучникова, Н.П. Чувашина // Бюллетень научной информации ЦГЛ им. И.В. Мичурина. – Вып. 22. – Мичуринск, 1975. – С. 58-61.
Литература
2. Пухальский, В.А. Практикум по цитологии и цитогенетики растений / В.А. Пухальский, А.А. Соловьев, Е.Д. Бадаева, В.Н. Юрцев. – М.: КолосС, 2007. – 198 с.
3. Топильская, Л.А. Изучение соматических и мейотических хромосом смородины на ацетогематоксилиновых давленых препаратах / Л.А. Топильская, С.В. Лучникова, Н.П. Чувашина // Бюллетень научной информации ЦГЛ им. И.В. Мичурина. – Вып. 22. – Мичуринск, 1975. – С. 58-61.
 Похожие темы
Похожие темы» УСТОЙЧИВОСТЬ ГЕНОТИПОВ ВИШНИ К АБИОТИЧЕСКИМ И БИОТИЧЕСКИМ ФАКТОРАМ Кружков Ал.В.
» CЕЛЕКЦИОННАЯ ОЦЕНКА ИСХОДНЫХ ФОРМ СМОРОДИНЫ ЧЁРНОЙ ПО СОДЕРЖАНИЮ В ПЛОДАХ ПЕКТИНОВЫХ ВЕЩЕСТВ Сазонов Ф.Ф.1, Подгаецкий М.А.2
» ВЛИЯНИЕ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ НА СНИЖЕНИЕ УРОВНЯ ВИТРИФИКАЦИИ МИКРОПОБЕГОВ КЛОНОВЫХ ПОДВОЕВ ЯБЛОНИ И ГРУШИ IN VITRO Матушкина О.В., Пронина И.Н.
» CЕЛЕКЦИОННАЯ ОЦЕНКА ИСХОДНЫХ ФОРМ СМОРОДИНЫ ЧЁРНОЙ ПО СОДЕРЖАНИЮ В ПЛОДАХ ПЕКТИНОВЫХ ВЕЩЕСТВ Сазонов Ф.Ф.1, Подгаецкий М.А.2
» ВЛИЯНИЕ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ НА СНИЖЕНИЕ УРОВНЯ ВИТРИФИКАЦИИ МИКРОПОБЕГОВ КЛОНОВЫХ ПОДВОЕВ ЯБЛОНИ И ГРУШИ IN VITRO Матушкина О.В., Пронина И.Н.
:: Обсуждения, беседы, обмен опытом :: Обсуждение присланных на конференцию "Новые сорта садовых культур: их достоинства и экономическая эффективность возделывания" материалов
Страница 1 из 1
Права доступа к этому форуму:
Вы не можете отвечать на сообщения|
|
|